当前位置:新闻资讯-课题研究
当前位置:新闻资讯-课题研究
探究铁及其化合物的氧化性或还原性 王东方
分类:课题研究 点击:5517 次 发布:2020-10-28
探究铁及其化合物的氧化性或还原性
郑州十一中 王东方
一、 教学背景分析
【教材分析】
本节课选自鲁科版《化学必修1》第二章《元素与物质世界》中的第三节——《氧化剂和还原剂》,本节课是这一节的第三课时。这节课的设计意图非常明显,就是让学生达到学以致用的目的,让学生应用氧化还原反应知识,自主设计实验和有关的活动方案,探究铁及其化合物的性质。在探究的过程中,注重发展学生学习化学的兴趣和培养他们科学探究的能力。该案例以与铁有关的趣味魔术导入新课,激发兴趣,并预测含有不同价态铁元素的各种物质哪些具有氧化性或还原性或既具有氧化性又有还原性。然后提出问题,怎么验证推测是否正确,并引导学生根据氧化还原反应理论设计验证方案来验证推测。实施实验后,对实验结果进行分析、整理,确定含有不同价态铁元素物质具有的性质和相互转化关系,最后根据结论解释生产生活中的实际问题。
在新课程理念中,把过去的演示和证明科学知识的活动转变为探究和分析科学问题的活动,学生学会从中研究和分析问题,提倡在实践中学习知识、技能和方法,帮助学生运用观察、实验、调查等方法广泛获取信息,从日常现象和化学学习中提出问题,做出猜想或假设,自主设计实验和有关的活动方案,寻求解决问题的依据或证据,定性或定量的处理有关的信息和资料。在探究中学会表达和交流,善于与同伴合作,从中体验互动的乐趣和积极的情感,养成学生科学的态度和价值观。
【学情分析】
(1) 学生已有的认知基础
在知识层面,学生已掌握单质铁的化学性质及氧化还原反应的实质,这为探究铁的化合物的氧化性还原性提供了基础。在能力层面上,学生已经具备了一定的信息提取与加工能力,也在以往学习中积累了一定的实验设计经验,但利用所学知识设计实验的能力有待加强。在情感层面,由于铁及其化合物在生活中的应用较为广泛,学生也对其用途有较多的关注,在本节课中应该引导学生从铁及其化合物性质的角度出发,进一步关注其在生产生活中的用途。
(2) 学生学习本课的困难
在探究铁及其化合物相互转化关系,设计实验的过程中,学生难以准确找到合适的氧化剂或还原剂实现实验目的。
二、教学方式
1.运用分类的方法,根据物质所属类别预测物质性质。
2.整合实验过程,设计问题进行引导,启发式教学。
三、教具、实验器材
多媒体电脑、实验试剂(铁粉、稀盐酸、氯化铁溶液、氯化亚铁溶液、新制氯水、稀硝酸、硫氰酸钾溶液、酸性高锰酸钾溶液、锌粒、铜片)
四、教学目标
1、通过趣味化学魔术,掌握铁离子的检验方法
2、通过小组讨论和实验探究,掌握铁及其化合物的氧化性或还原性
3、通过小组讨论,利用所学理论解释生产生活中与铁有关的实际问题
4、通过演示实验,探究Fe2+与H2O2反应的原理,并根据研究物质性质的基本程序,对实验中的一些特殊现象进行进一步探究,解决问题。
五、教学重难点
1.知识重难点:不同价态铁的氧化性和还原性
2. 技能重难点:预测并通过实验探究物质性质的科学方法
六、教学过程
教学阶段 | 教师活动 | 学生活动 | 设计意图 | 技术应用 | 时间安排 |
创设情境 | 【魔术引入】喷雾显字,准备好装有KSCN溶液的喷壶、盛有FeCl3的烧杯以及毛笔一支,邀请一名擅长书法的同学上台进行喷雾显字的魔术 【揭秘魔术】Fe3+遇到KSCN生成Fe(SCN)3变红色 【理论支持】利用此原理,可以用KSCN溶液检验三价铁,二价铁遇到KSCN无此变化。 【联系生活】利用多媒体展示港珠澳大桥以及含铁的食物、药品。 | 学生上台用蘸有FeCl3的毛笔在一张纸上写出一个“铁”字,并用喷壶喷上KSCN溶液,原来浅黄色的字立马变成了鲜艳的红色。其他学生观看、思考。 学生倾听、记录。
观看,体会铁对于人类生产、生活的重要性。 | 利用趣味魔术以及生活中铁及其化合物的广泛应用,激发学生的学习兴趣,加深学生对铁及其化合物性质的理解。 | 实验器材、药品、多媒体电脑、教材 | 5分钟 |
理论分析 | 【思考】写出常见铁的化合物的化学式,并标出铁的化合价,然后依据不同价态对铁进行分类,并从氧化还原的角度预测它们具有什么性质。
【方法引导】如果你预测某物质具有氧化性,就应该寻找具有还原性的另一物质,通过实验证实两者能发生氧化还原反应来检验你的预测。预测物质具有还原性也是如此。
【布置任务】请大家根据物质的氧化性和还原性,把下列药品分分类吧 | 学生思考并阅读教材后回答问题,提出假设 金属铁——还原性 氯化亚铁——氧化性和还原性 氯化铁——氧化性
学生思考、记录
学生把药品进行分类 氧化剂:氯水、高锰酸钾、稀盐酸 还原剂:锌粒、铁片、铜片 | 引导学生从化合价的角度预测物质性质。使学生明确探究的整体思路和探究的方法
巩固氧化剂、还原剂的相关知识,为下一步实验探究作理论依据 | 多媒体电脑 实验试剂(铁粉、稀盐酸、氯化铁溶液、氯化亚铁溶液、新制氯水、稀硝酸、硫氰酸钾溶液、酸性高锰酸钾溶液、锌粒、铜片)
| 5分钟 |
实验探究 | 【探究实验】请用上述实验试剂设计并完成实验探究铁及其化合物的氧化性、还原性,完成实验报告
【实验要求】 1、明确小组实验目的 2、设计实验操作步骤 (有明显现象!) 3、注意实验操作规范 4、观察记录实验现象 5、写反应离子方程式
【提问1】首先我们探究单质铁的还原性,同学们有什么好的方案?
【点评1】同学们设计的实验非常好,请大家整合所有的方案、现象并填写相关的实验报告
【提问2】接下来我们来看FeCl2的氧化性及还原性探究,请同学们结合自己刚才所做的实验踊跃发言,展示你们的成果。
【点评2】非常好!大家可以根据同学们的回答,整合自己的实验报告。
【追问】在验证二价铁还原性实验中,如果加入氯水,同学们观察的实验现象如何?明显吗?如果不明显我们能不能结合本节课的“魔术知识”来检验产生的三价铁呢?
【引导归纳】我们可以利用此原理检验溶液中的Fe3+以及Fe2+ 【提问3】最后我们来讨论一下FeCl3的氧化性,这次同学们又有什么样的方案呢?
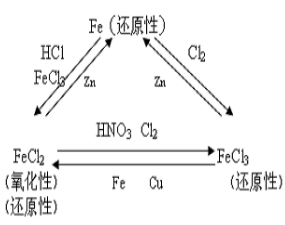
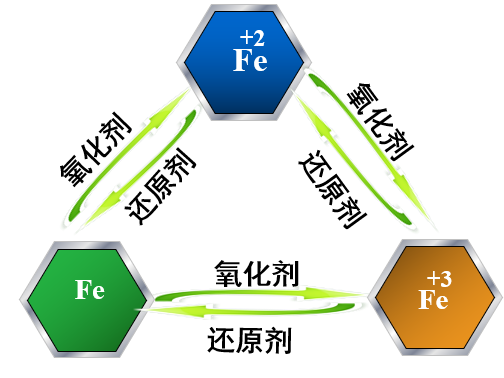
【归纳总结】 1、铁三角
2、相关的离子反应方程式
| 学生小组讨论完成实验方案的设计,动手进行实验、观察实验现象并完成实验记录。
学生讨论、设计实验并动手操作
学生派小组代表发言,展示实验方案、操作、现象及结论: 铁+稀盐酸、铁+硫酸铜溶液
学生派小组代表发言,展示实验方案、操作、现象及结论: 氧化性——’ FeCl2+Zn 还原性—— FeCl2+氯水、 FeCl2+酸性高锰酸钾
学生回答:溶液由浅绿色转变为黄色,但是现象不太明显。可以先在溶液中滴加KSCN溶液,溶液无明显变化,但是加入氯水后,溶液由浅绿色变为红色,现象明显
学生总结、记录。
学生派小组代表发言,展示实验方案、操作、现象及结论: 氯化铁+铜、铁、锌,为了使现象明显,可加入KSCN溶液。
学生聆听 | 培养学生应用氧化还原知识,通过通过实验验证物质氧化性、还原性的过程与方法以及实验设计、操作、观察和记录的基本科学素养。
让学生以实验事实为基础,从中得出新的结论,体味探索的乐趣。
培养学生学以致用的能力。
培养学生归纳总结的能力。 | 多媒体电脑 实验试剂(铁粉、稀盐酸、氯化铁溶液、氯化亚铁溶液、新制氯水、稀硝酸、硫氰酸钾溶液、酸性高锰酸钾溶液、锌粒、铜片)
| 20分钟 |
拓展应用 | 【问题1】请解释实验室配制FeSO4溶液时加铁粉的作用。 【问题2】过去电子工业常用30%的FeCl3溶液腐蚀有铜箔的绝缘板,制造制造印刷线路板。请说出其中发生的反应原理。 【问题3】工业生产中,往往需要将酸性的FeSO4溶液转化为Fe2(SO4)3,假如你是工业流程设计师,请选择选择合适的氧化剂 A.稀硝酸 B.氯气 C. 高锰酸钾溶液D.过氧化氢 【提问】大家可以模拟这个实验,先在FeSO4溶液中滴入KSCN溶液,再滴入过氧化氢溶液。 【追问】产生的气体是什么? 【探究实验】将带火星的小木条放入试管中,发现木条复燃,证明产生的气体是氧气。 【追问】这个实验说明过氧化氢被分解产生了氧气,联系初中知识,过氧化氢分解制氧气需要催化剂。大胆预测该实验生成的三价铁可以做过氧化氢分解的催化剂,请大家设计实验验证猜测。 【课后作业】 1、 探究身边食物中的铁元素 2、 上网搜索缺铁性贫血的症状。 | 学生回答铁粉可以防止二价铁被空气中的氧气氧化。 学生回答三价铁可以和铜发生氧化还原反应,即 2Fe3+ + Cu==2Fe2+ + Cu2+
学生从实验可行性以及绿色环保的角度思考,选择过氧化氢作为催化剂。
学生模拟实验,发现溶液颜色从从浅绿色变为红色,除此以外,溶液中产生大量气泡。 学生猜测可能是氧气或氢气。 通过探究实验验证产生的气体为氧气。
学生进行验证实验,取两个试管,滴入等浓度等体积的过氧化氢溶液,一个试管中滴入氯化铁溶液,另一个试管中滴入等量的蒸馏水,发现滴有氯化铁的试管产生大量气泡,而滴有蒸馏水的试管无明显现象,从而验证之前的猜测。 | 引导学生把氧化还原的知识应用到生产生活中,解决实际问题。
创设情景,假设学生是工业流程设计师,树立学生的主人翁意识,激发兴趣,增强学生的参与感。同时有意识培养学生绿色化学、可持续发展的理念。
让学生自己动手体会研究物质的基本程序,尤其在遇到与预测不同的特殊实验现象时,引导学生大胆预测、严谨求证。 | 多媒体电脑。 实验试剂(硫酸亚铁溶液、氯化铁溶液、过氧化氢溶液、KSCN溶液、小木条。) | 10分钟 |
板书设计 | 探究铁及其化合物的氧化性或还原性 探究一:单质铁的还原性 探究二:三价铁的氧化性 Fe+2H+ == Fe2+ + H2↑ 2Fe3+ + Fe == 3Fe2+ 2Fe3+ + Cu == 2Fe2+ + Cu2+
探究三:二价铁的还原性 探究四:二价铁的氧化性 2Fe2+ + Cl2 == 2Fe3+ + 2Cl- Fe2+ + Zn == Zn2+ + Fe 5Fe2++8H++MnO4-== 5Fe3++Mn2++4H2O
| ||||
七、教学反思
1、设计导学案,实验设计、记录更加规范化
2、注重组织方式,争取让每个学生都真正参与进来
3、一些口误,语言的严谨性
4、学生演示实验,突出学生的主导地位,教师做好引导工作即可
5、学生分组实验细节的录制